Kristal strukturların əsas xüsusiyyətləri. Kristal strukturların əsas növləri Kristal quruluşu və onun təsviri
Anlayışlar arasında fərq qoymaq lazımdır kristal hüceyrə Və kristal quruluşu. Kristalın quruluşu fiziki reallıqdır, müxtəlif atomların fəzada spesifik düzülüşüdür. Kristal qəfəs yalnız kristal hissəciklərin düzülüşündə simmetriyanı əks etdirən strukturun həndəsi təsviridir. Kristalların strukturunun daha dolğun təsviri üçün əsas anlayışından istifadə olunur. Kristal quruluşun əsasları vahid hüceyrə başına fəzada müəyyən şəkildə yerləşən müxtəlif atomların toplusu adlanır. Bunlar. Tamamilə bir vahid hüceyrəyə aid olan bütün atomlar bu hüceyrədəki koordinatları ilə birlikdə siyahıya alınmışdır. Beləliklə, vahid hüceyrə kristalın qurulduğu "elementar kərpiclərin" ölçüsünü və formasını müəyyənləşdirirsə, əsas bu kərpiclərin "materialını" müəyyənləşdirir. Başqa sözlə, əsas kosmosda dövri təkrarlanması nəzərdən keçirilən bütün kristalı təkrarlayan "maddənin elementar bloku" dır.
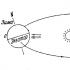
Böyük molekullardan ibarət mürəkkəb üzvi kristalların əsasına bir neçə min müxtəlif atom daxil ola bilər. Ən sadə halda, kristal şəbəkənin düyünlərində eyni tipli atomlar və ya ionlar olduqda, əsas yalnız bir və ya bir neçə belə hissəcikdən ibarətdir. Bənzər bir vəziyyət, xüsusən də metallar üçün xarakterikdir. Əgər metalın strukturu primitiv hüceyrəsi olan kristal qəfəslə təsvir edilirsə (şəkil 1), onda belə strukturun əsasını verilmiş metalın yalnız bir atomundan təşkil edir. (Həqiqətən, bu halda, kristal qəfəsin düyünündə yerləşən hər bir metal atomu 8 oxşar hüceyrənin kəsişməsində yerləşir və yalnız ⅛ ilə sözügedən hüceyrəyə aiddir. Lakin hüceyrədə 8 belə düyün olduğundan, onda tam olaraq bir atom ona aiddir, bazanı təyin edir. Bədən mərkəzli hüceyrə vəziyyətində əsas 2 metal atomundan ibarətdir (hüceyrənin mərkəzindəki atom tamamilə bu hüceyrəyə aiddir, üstəlik bir atom hüceyrənin təpələrində yerləşən düyünlər tərəfindən təmin edilir) və üz mərkəzli hüceyrə - 4 (üzlərin mərkəzlərində yerləşən 6 atomun hər biri sözügedən hüceyrəyə yalnız ½ hissəsi aiddir).
Simmetriya sistemi, qəfəs dövrünün dəyərləri və əsası müəyyən bir materialın kristal quruluşunu tamamilə müəyyənləşdirir. Əgər bu parametrlər məlumdursa, o zaman kristalın quruluşu da məlum sayılır. Bununla belə, strukturun daha dolğun təsviri üçün bəzən koordinasiya nömrəsi və yığcamlıq əmsalı kimi əlavə parametrlərdən istifadə olunur. Koordinasiya nömrəsi istənilən atomun ən yaxın bərabər məsafəli qonşularının sayıdır. Məsələn, Şəkildə göstərilən quruluşu götürsək. 1, onda onun koordinasiya nömrəsi altıdır. Kompaktlıq faktoru(yığcamlıq dərəcəsi) atomların tutduğu həcmin vahid hüceyrənin bütün həcminə nisbətidir. Təmiz metallar vəziyyətində yığcamlıq əmsalı 0,74-ə çata bilər. Bu o deməkdir ki, metalın həcminin 74%-i atomlar, qalan hissəsini isə boşluqlar (məsamələr) tutur.
Bərk cisimlər amorf cisimlərə və kristallara bölünür. İkincinin birincidən fərqi ondan ibarətdir ki, kristalların atomları müəyyən qanuna uyğun düzülür və bununla da üçölçülü dövri düzülmə əmələ gəlir ki, bu da kristal qəfəs adlanır.
Maraqlıdır ki, kristalların adı yunanca "dondurmaq" və "soyuq" sözlərindən gəlir və Homerin dövründə bu sözdən sonra "donmuş buz" hesab edilən qaya kristalını təsvir etmək üçün istifadə edilmişdir. Əvvəlcə bu termin yalnız üzlü şəffaf birləşmələri təsvir etmək üçün istifadə edilmişdir. Lakin sonradan təbii mənşəli qeyri-şəffaf və kəsilməmiş cisimlər də kristal adlandırılmağa başladı.

Kristal quruluş və qəfəs
İdeal bir kristal vaxtaşırı təkrarlanan eyni strukturlar şəklində təmsil olunur - kristalın elementar hüceyrələri. Ümumiyyətlə, belə bir hüceyrənin forması əyri paralelepipeddir.
Kristal qəfəs və kristal quruluş kimi anlayışları bir-birindən ayırmaq lazımdır. Birincisi kosmosda müəyyən nöqtələrin nizamlı düzülməsini təsvir edən riyazi abstraksiyadır. Kristal quruluş həqiqi fiziki obyekt olsa da, kristal qəfəsin hər bir nöqtəsi ilə müəyyən bir atom və ya molekul qrupunun əlaqəli olduğu bir kristal.

Qranatın kristal quruluşu - romb və dodekaedr
Kristalın elektromaqnit və mexaniki xassələrini müəyyən edən əsas amil vahid hüceyrənin və onunla əlaqəli atomların (molekulların) quruluşudur.
Kristalların anizotropiyası
Kristalları amorf cisimlərdən fərqləndirən əsas xüsusiyyət anizotropiyadır. Bu o deməkdir ki, kristalın xüsusiyyətləri istiqamətindən asılı olaraq müxtəlifdir. Məsələn, qeyri-elastik (dönməz) deformasiya yalnız kristalın müəyyən müstəviləri boyunca və müəyyən bir istiqamətdə baş verir. Anizotropiyaya görə kristallar deformasiyaya onun istiqamətindən asılı olaraq fərqli reaksiya verirlər.
Bununla belə, anizotropiyaya malik olmayan kristallar var.
Kristalların növləri

Kristallar monokristallara və polikristallara bölünür. Monokristallar kristal quruluşu bütün bədənə yayılan maddələrdir. Belə cisimlər homojendir və davamlı kristal qəfəsə malikdir. Tipik olaraq, belə bir kristalın açıq bir kəsilməsi var. Təbii tək kristallara misal olaraq qaya duzunun, almazın və topazın və kvarsın tək kristallarını göstərmək olar.

Bir çox maddələr kristal quruluşa malikdir, baxmayaraq ki, onlar adətən kristalların xarakterik formasına malik deyillər. Belə maddələrə, məsələn, metallar daxildir. Tədqiqatlar göstərir ki, belə maddələr çoxlu sayda çox kiçik monokristallardan - kristal dənələrindən və ya kristalitlərdən ibarətdir. Belə bir çox fərqli yönümlü monokristaldan ibarət olan maddə polikristal adlanır. Polikristallarda çox vaxt faset yoxdur və onların xassələri kristal dənələrinin orta ölçüsündən, onların nisbi mövqeyindən, həmçinin taxıl sərhədlərinin strukturundan asılıdır. Polikristallara metallar və ərintilər, keramika və minerallar, eləcə də başqaları kimi maddələr daxildir.

Giriş
Kristal cisimlər mineralların növlərindən biridir.
Kristal fiziki xassələri müxtəlif istiqamətlərdə eyni olmayan, paralel istiqamətlərdə eyni olan bərk cisimlərdir.
Kristal bərk cisimlər ailəsi iki qrupdan ibarətdir - monokristallar və polikristallar. Birincilər bəzən həndəsi nizamlı xarici formaya malikdirlər, ikincilər isə amorf cisimlər kimi verilmiş maddəyə xas olan spesifik formaya malik deyillər. Lakin amorf cisimlərdən fərqli olaraq, polikristalların quruluşu heterojen və dənəvərdir. Onlar bir-biri ilə birləşmiş xaotik yönümlü kiçik kristalların - kristalitlərin toplusudur. Məsələn, çuqun polikristal quruluşu, sınıq nümunəni böyüdücü şüşə ilə tədqiq etməklə aşkar edilə bilər.
Kristalların ölçüləri müxtəlifdir. Onların bir çoxunu yalnız mikroskopla görmək olar. Ancaq bir neçə ton ağırlığında nəhəng kristallar var.
Kristal quruluş
Formada olan kristalların müxtəlifliyi çox böyükdür. Kristallar dörddən bir neçə yüz aspektə qədər ola bilər. Ancaq eyni zamanda, onların diqqətəlayiq bir xüsusiyyəti var - eyni kristalın ölçüsü, forması və üzlərinin sayı nə olursa olsun, bütün düz üzlər müəyyən bucaqlarda bir-biri ilə kəsişir. Müvafiq üzlər arasındakı bucaqlar həmişə eynidir. Məsələn, qaya duzunun kristalları kub, paralelepiped, prizma və ya daha mürəkkəb formalı gövdə formasına malik ola bilər, lakin onların üzləri həmişə düz bucaq altında kəsişir. Kvarsın üzləri nizamsız altıbucaqlılara bənzəyir, lakin üzlər arasındakı bucaqlar həmişə eynidir - 120°.
1669-cu ildə danimarkalı Nikolay Steno tərəfindən kəşf edilən bucaqların sabitliyi qanunu kristallar elminin ən mühüm qanunu - kristalloqrafiyadır.
Kristalların üzləri arasındakı bucaqların ölçülməsi çox böyük praktik əhəmiyyətə malikdir, çünki bu ölçmələrin nəticələrinə əsasən bir çox hallarda mineralın təbiəti etibarlı şəkildə müəyyən edilə bilər. Kristal bucaqları ölçmək üçün ən sadə cihaz tətbiq olunan goniometrdir. Tətbiq olunan goniometrdən istifadə yalnız böyük kristalları öyrənmək üçün mümkündür; Tətbiq olunan qoniometrdən istifadə edərək, məsələn, formaca oxşar və birinci üçün 101°55" və ikinci üçün 102°41,5"-ə bərabər olan müvafiq üzləri arasında bucaqları olan kalsit və nitrat kristallarını ayırd etmək çox çətindir. Buna görə də, laboratoriya şəraitində kristal üzləri arasındakı bucaqların ölçülməsi adətən daha mürəkkəb və dəqiq alətlərdən istifadə etməklə aparılır.
Normal həndəsi formalı kristallar təbiətdə nadirdir. Temperaturun dəyişməsi və qonşu bərk cisimlərlə yaxın ətraf kimi əlverişsiz amillərin birgə təsiri böyüyən kristalın xarakterik formasını almasına imkan vermir. Bundan əlavə, uzaq keçmişdə mükəmməl kəsilmiş kristalların əhəmiyyətli bir hissəsi suyun, küləyin və digər bərk maddələrlə sürtünmənin təsiri altında onu itirməyi bacardı. Beləliklə, sahil qumunda tapıla bilən bir çox dairəvi şəffaf dənələr bir-birinə uzun sürtünmə nəticəsində kənarlarını itirmiş kvars kristallarıdır.
Bərk cismin kristal olub olmadığını müəyyən etməyin bir neçə yolu var. Onlardan ən sadə, lakin istifadə üçün çox yararsız olanı 18-ci əsrin sonlarında təsadüfi müşahidələr nəticəsində aşkar edilmişdir. Fransız alimi Renne Qahuy kolleksiyasından təsadüfən kristallardan birini yerə atıb. Kristal fraqmentləri araşdırdıqdan sonra o, onların bir çoxunun orijinal nümunənin daha kiçik nüsxələri olduğunu gördü.
Bir çox kristalın əzilən zaman orijinal kristala bənzər formada fraqmentlər meydana gətirmək üçün əlamətdar xüsusiyyəti Haüyə bütün kristalların mikroskop altında görünməyən, müntəzəm həndəsi formaya malik, sıx şəkildə yığılmış kiçik hissəciklərdən ibarət olduğunu fərz etməyə imkan verdi. verilmiş maddə. Qayuy həndəsi fiqurların müxtəlifliyini təkcə onların düzəldildiyi “kərpiclərin” müxtəlif formaları ilə deyil, həm də onların düzülmə üsulları ilə izah edirdi.
Hayuyanın fərziyyəsi fenomenin mahiyyətini - kristalların struktur elementlərinin nizamlı və sıx düzülməsini düzgün əks etdirdi, lakin bir sıra vacib suallara cavab vermədi. Formanı saxlamaq üçün bir məhdudiyyət varmı? Əgər varsa, ən kiçik "kərpic" nədir? Maddənin atomları və molekulları çoxüzlü formaya malikdirmi?
18-ci əsrdə. İngilis alimi Robert Huk və holland alimi Kristian Huygens sıx şəkildə yığılmış toplardan müntəzəm çoxüzlülərin qurulmasının mümkünlüyünə diqqət çəkdilər. Onlar kristalların sferik hissəciklərdən - atomlardan və ya molekullardan qurulduğunu irəli sürdülər. Bu fərziyyəyə görə kristalların xarici formaları atomların və ya molekulların sıx yığılmasının xüsusiyyətlərinin nəticəsidir. Onlardan asılı olmayaraq, 1748-ci ildə böyük rus alimi M.V. Lomonosov.
Toplar bir düz təbəqəyə sıx şəkildə yığıldıqda, hər bir top, mərkəzləri müntəzəm altıbucaqlı təşkil edən altı başqa topla əhatə olunur. İkinci təbəqə birinci təbəqənin topları arasındakı deliklər boyunca qoyulursa, ikinci təbəqə birinci ilə eyni olacaq, yalnız kosmosda ona nisbətən yerdəyişəcəkdir.
Topların üçüncü qatının qoyulması iki şəkildə edilə bilər. Birinci üsulda, üçüncü təbəqənin topları birinci təbəqənin toplarının tam üstündə yerləşən deliklərə yerləşdirilir və üçüncü təbəqə birincinin dəqiq surəti olur. Sonradan təbəqələrin yığılmasının bu şəkildə təkrarlanması ilə altıbucaqlı sıx yığılmış struktur adlanan bir quruluş əldə edilir. İkinci üsulda, üçüncü təbəqənin topları birinci təbəqənin toplarından tam olaraq yuxarıda olmayan deliklərə yerləşdirilir. Bu qablaşdırma üsulu kubik sıx paketli struktur adlanan bir quruluş yaradır. Hər iki paket 74% həcmdə doldurma dərəcəsi verir. Topların deformasiyası olmadıqda kosmosda yerləşdirməyin başqa heç bir üsulu daha böyük həcmdə doldurulma təmin etmir.
Altıbucaqlı bağlama üsulundan istifadə edərək topları sıra ilə qoyarkən, adi altıbucaqlı prizma əldə edə bilərsiniz, ikinci qablaşdırma üsulu toplardan bir kub qurma ehtimalına səbəb olur.
Atomlardan və ya molekullardan kristalların qurulması zamanı sıx bağlama prinsipi tətbiq edilərsə, o zaman kristallara təbiətdə yalnız altıbucaqlı prizmalar və kublar şəklində rast gəlindiyi görünür. Bu formanın kristalları həqiqətən çox yayılmışdır. Atomların altıbucaqlı sıx bağlanması, məsələn, sink, maqnezium və kadmium kristallarının formasına uyğundur. Kub sıx qablaşdırma mis, alüminium, gümüş, qızıl və bir sıra digər metalların kristallarının formasına uyğundur.
Lakin kristallar dünyasının müxtəlifliyi bu iki forma ilə məhdudlaşmır.
Bərabər ölçülü kürələrin ən yaxın qablaşdırılması prinsipinə uyğun gəlməyən kristal formaların mövcudluğu müxtəlif səbəblərə malik ola bilər.
Birincisi, kristal sıx qablaşdırma prinsipinə uyğun olaraq, lakin müxtəlif ölçülü atomlardan və ya sferikdən çox fərqli bir formaya malik molekullardan tikilə bilər. Oksigen və hidrogen atomları sferik formaya malikdir. Bir oksigen atomu və iki hidrogen atomu birləşdirildikdə, onların elektron qabıqlarının qarşılıqlı nüfuzu baş verir. Buna görə də, su molekulu sferikdən əhəmiyyətli dərəcədə fərqli bir forma malikdir. Su qatılaşdıqda, onun molekullarının sıx şəkildə yığılması bərabər ölçülü kürələrin qablaşdırılması ilə eyni şəkildə həyata keçirilə bilməz.
İkincisi, atomların və ya molekulların qablaşdırılması ilə ən sıxı arasındakı fərq, onlar arasında müəyyən istiqamətlərdə daha güclü bağların olması ilə izah edilə bilər. Atom kristalları vəziyyətində, bağların istiqaməti atomların xarici elektron qabıqlarının quruluşu ilə, molekulyar kristallarda - molekulların quruluşu ilə müəyyən edilir.
Yalnız strukturlarının üçölçülü modellərindən istifadə edərək kristalların quruluşunu başa düşmək olduqca çətindir. Bununla əlaqədar olaraq, kristalların quruluşunu məkan kristal qəfəsdən istifadə edərək təsvir etmək üsulu tez-tez istifadə olunur. Bu, düyünləri kristaldakı atomların (molekulların) mərkəzlərinin mövqeyi ilə üst-üstə düşən məkan şəbəkəsidir. Bu cür modelləri görmək olar, lakin onlardan kristalları təşkil edən hissəciklərin forması və ölçüsü haqqında heç nə öyrənmək mümkün deyil.
Kristal qəfəs elementar hüceyrəyə əsaslanır - ardıcıl ötürülməsi bütün kristalı qura bilən ən kiçik ölçülü bir rəqəmdir. Hüceyrəni unikal şəkildə xarakterizə etmək üçün onun a, b və c kənarlarının ölçülərini, bucaqların və onların arasında olan ölçüləri təyin etməlisiniz. Kenarlardan birinin uzunluğu kristal qəfəs sabiti adlanır və hüceyrəni təyin edən altı qiymətin bütün dəsti hüceyrə parametrləri adlanır.
Çox atomların və bir çox kristal qəfəs növləri üçün hər bir atomun bir vahid hüceyrəyə aid olmadığına, eyni zamanda bir neçə qonşu vahid hüceyrənin bir hissəsi olduğuna diqqət yetirmək vacibdir. Məsələn, qaya duzu kristalının vahid hüceyrəsini nəzərdən keçirək.
Şəkildə göstərilən kristalın hissəsi kosmosda köçürmə yolu ilə bütün kristalın tikilə biləcəyi bir qaya duzu kristalının elementar hüceyrəsi kimi qəbul edilməlidir. Bu zaman nəzərə almaq lazımdır ki, hüceyrənin təpələrində yerləşən ionların hər birinin yalnız səkkizdə biri ona aiddir; hüceyrənin kənarlarında yatan ionların hər birinin dörddə biri ona aiddir; Üzlərdə uzanan ionlardan iki qonşu vahid hüceyrənin hər biri ionun yarısını təşkil edir.
Daş duzunun bir vahid hüceyrəsinə daxil olan natrium ionlarının sayını və xlor ionlarının sayını hesablayaq. Hüceyrə tamamilə hüceyrənin mərkəzində yerləşən bir xlor ionunu və hüceyrənin kənarlarında yerləşən 12 ionun hər birinin dörddə birini ehtiva edir. Bir hüceyrədə ümumi xlor ionları 1+12*1/4=4-dür. Vahid hüceyrədəki natrium ionları üzlərdə altı yarım və təpələrdə səkkizdə səkkizdir, cəmi 6*1/2+8*1/8=4.
Müxtəlif növ kristal qəfəslərin vahid hüceyrələrinin müqayisəsi müxtəlif parametrlərdən istifadə etməklə həyata keçirilə bilər, bunlar arasında atom radiusu, qablaşdırma sıxlığı və vahid hüceyrədəki atomların sayı tez-tez istifadə olunur. Atom radiusu bir kristalda ən yaxın qonşu atomların mərkəzləri arasındakı məsafənin yarısı kimi müəyyən edilir.
Vahid hüceyrədə atomların tutduğu həcm hissəsinə qablaşdırma sıxlığı deyilir.
Kristalların təsnifatı və fiziki xassələrinin izahı yalnız onların simmetriyasını öyrənmək əsasında mümkündür. Simmetriya təlimi bütün kristalloqrafiyanın əsasını təşkil edir.
Simmetriya dərəcəsini ölçmək üçün simmetriya elementlərindən - oxlar, müstəvilər və simmetriya mərkəzi istifadə olunur. Simmetriya oxu xəyali düz xəttdir, 360° fırlandıqda onun ətrafında kristal (və ya onun qəfəsi) bir neçə dəfə özü ilə düzləşir. Bu hizalanmaların sayı ox sırası adlanır.
Simmetriya müstəvisi, kristalı iki hissəyə kəsən, hər biri bir-birinin güzgü şəkli olan bir təyyarədir.
Simmetriya müstəvisi ikitərəfli güzgü kimi çıxış edir. Simmetriya müstəvilərinin sayı müxtəlif ola bilər. Məsələn, onlardan doqquzu kubda, altısı isə istənilən formalı qar dənəciklərindədir.
Simmetriya mərkəzi kristalın içərisində bütün simmetriya oxlarının kəsişdiyi nöqtədir.
Hər bir kristal simmetriya elementlərinin müəyyən birləşməsi ilə xarakterizə olunur. Simmetriya elementlərinin sayı az olduğuna görə, bütün mümkün kristal formaları tapmaq vəzifəsi ümidsiz deyil. Görkəmli rus kristalloqrafı Evqraf Stepanoviç Fedorov müəyyən etdi ki, təbiətdə ikinci, üçüncü, dördüncü və altıncı dərəcəli simmetriya oxlarına malik olan cəmi 230 müxtəlif kristal qəfəs ola bilər. Başqa sözlə, kristallar müxtəlif prizma və piramidaların formasına malik ola bilər, onların əsası yalnız düzgün üçbucaq, kvadrat, paraleloqram və altıbucaqlı ola bilər.
E.S. Fedorov kristal kimyasının banisidir - üzlərin formasını öyrənmək və onlar arasındakı bucaqları ölçməklə kristalların kimyəvi tərkibini təyin etməklə məşğul olan elmdir. Kristal kimyəvi analiz adətən kimyəvi analizdən daha az vaxt alır və nümunənin məhvinə səbəb olmur.
Fedorovun bir çox müasirləri nəinki kristal qəfəslərin mövcudluğuna inanmırdılar, hətta atomların mövcudluğuna şübhə ilə yanaşırdılar. Fedorovun nəticələrinin etibarlılığına dair ilk eksperimental sübut 1912-ci ildə alman fiziki E.Laue tərəfindən əldə edilmişdir. Onun rentgen şüalarından istifadə edərək cisimlərin atom və ya molekulyar quruluşunu təyin etmək üçün işləyib hazırladığı üsul rentgen şüalarının difraksiya analizi adlanır. X-şüalarının difraksiya analizindən istifadə edərək kristalların quruluşunun öyrənilməsinin nəticələri bütün hesablanmış E.S.-nin mövcudluğunun reallığını sübut etdi. Fedorov kristal qəfəsləri. Bu metodun nəzəriyyəsi məktəb fizikası kursunda əhatə oluna bilməyəcək qədər mürəkkəbdir.
Kristalların daxili quruluşunun əyani təsviri kristalların quruluşunu öyrənmək üçün yeni əlamətdar cihaz - 1951-ci ildə ixtira edilmiş ion mikroproyektoru ilə təmin edilmişdir. Mikroproyektorun cihazı televizor şəkil borusunun (puc.5) cihazına bənzəyir. ). Şüşə qabda diametri təqribən 10 -5 -10 -6 sm olan çox nazik iynə 1 şəklində tədqiq olunan metal kristal var, iynənin ucu ilə üzbəüz bombardman zamanı parlaya bilən lüminessent ekran 2 yerləşir. sürətli hissəciklər tərəfindən. Balondan havanı diqqətlə çıxardıqdan sonra içərisinə az miqdarda helium daxil edilir. İğnə ilə ekran arasında təxminən 30.000 V gərginlik tətbiq olunur.
Helium atomları müsbət yüklü iynənin ucu ilə toqquşduqda hər dəfə bir elektron itirir və müsbət ionlara çevrilir. Çox vaxt helium atomlarının toqquşması ucun səthinin çıxıntılı hissələri ilə - metal qəfəsdən "ayrı-ayrı atomlar və ya atom qrupları çıxması ilə" baş verir. Buna görə də, helium ionlaşması əsasən belə çıxıntıların yaxınlığında baş verir. Hər bir çıxıntı-atomdan iondan sonra ion mənfi yüklü katod 3 istiqamətində düz xətlərlə uçur. Onlar ekrana toxunduqda onun parlamasına səbəb olur və ucu səthinin 10 7 dəfə böyüdülmüş görüntüsünü yaradır. Fotoşəkildəki işıq nöqtələrinin nöqtəli xətti atom təbəqələrinin pillələrinin kənarının təsviridir və işıq nöqtələrinin özləri pillələrin yuxarı hissəsindəki fərdi atomlardır. Bütün şəkil kristaldakı atomların yerləşməsinin dövriliyini və simmetriyasını yaxşı çatdırır.
Məqalənin məzmunu
KRİSTALLAR– ən kiçik hissəciklərin (atomlar, ionlar və ya molekullar) müəyyən bir ardıcıllıqla “qablaşdırıldığı” maddələr. Nəticədə kristallar böyüdükcə onların səthində kortəbii olaraq yastı kənarlar yaranır və kristallar özləri müxtəlif həndəsi formalar alırlar. Mineralogiya muzeyini və ya minerallar sərgisini ziyarət edən hər kəs “cansız” maddələrin aldığı formaların zərifliyinə və gözəlliyinə heyran olmaya bilməzdi.
Müxtəlifliyi həqiqətən sonsuz olan qar dənəciklərinə kim heyran olmayıb! 17-ci əsrdə. məşhur astronom Johannes Kepler bir traktat yazdı Altıbucaqlı qar dənəcikləri haqqında, və üç əsr sonra, minlərlə qar dənəciyinin böyüdülmüş fotoşəkillərindən ibarət kolleksiyaların təqdim edildiyi albomlar nəşr olundu və onların heç biri digərini təkrarlamadı.
“Kristal” sözünün mənşəyi maraqlıdır (bütün Avropa dillərində demək olar ki, eyni səslənir). Bir çox əsrlər əvvəl, Alp dağlarında əbədi qarlar arasında, müasir İsveçrənin ərazisində, çox gözəl, tamamilə rəngsiz kristallar tapıldı, təmiz buzu çox xatırladan. Qədim təbiətşünaslar onları - "krystallos", yunanca - buz adlandırırdılar; Bu söz yunanca "krios" - soyuq, şaxtadan gəlir. Güman edilirdi ki, dağlarda uzun müddət şiddətli şaxtada olan buz daşlaşır və ərimə qabiliyyətini itirir. Ən mötəbər antik filosoflardan biri Aristotel yazırdı ki, “kristallar sudan istiliyi tamamilə itirdikdə yaranır”. Roma şairi Klaudian da 390-cı ildə misrasında eyni şeyi təsvir etmişdir:
Acı alp qışında buz daşa çevrilir.
Günəş belə bir daşı əridə bilməz.
Bənzər bir nəticə qədim zamanlarda Çin və Yaponiyada edilmişdir - buz və qaya kristalı orada eyni sözlə təyin edilmişdir. Və hətta 19-cu əsrdə. şairlər tez-tez bu obrazları birləşdirib:
Gölün üzərində qaralmaqda olan şəffaf buz,
Kristal hərəkətsiz jetləri örtdü.
A.S.Puşkin. Ovidiyə
Kristallar arasında qədim zamanlardan insanların diqqətini cəlb edən qiymətli daşlar xüsusi yer tutur. İnsanlar bir çox qiymətli daşları süni yolla əldə etməyi öyrəniblər. Məsələn, saatlar və digər dəqiq alətlər üçün podşipniklər çoxdan süni yaqutlardan hazırlanır. Təbiətdə ümumiyyətlə olmayan gözəl kristallar da süni yolla əldə edilir. Məsələn, kub zirkoniya - onların adı FIAN abbreviaturasından gəlir - Elmlər Akademiyasının Fizika İnstitutu, burada ilk dəfə alındı. Kübik sirkoniyalar, zahiri olaraq almazlara çox oxşar olan kub sirkonium oksidi ZrO 2 kristallarıdır.
Kristalların quruluşu.
Quruluşundan asılı olaraq kristallar ion, kovalent, molekulyar və metallara bölünür. İon kristalları elektrostatik cazibə və itələmə qüvvələri tərəfindən müəyyən bir ardıcıllıqla tutulan alternativ kation və anionlardan qurulur. Elektrostatik qüvvələr qeyri-istiqamətlidir: hər bir ion özünə uyğun gələn qədər əks işarəli ionları öz ətrafında saxlaya bilər. Lakin eyni zamanda cazibə və itələmə qüvvələri balanslaşdırılmalı və kristalın ümumi elektrik neytrallığı qorunmalıdır. Bütün bunlar, ionların ölçüsünü nəzərə alaraq, müxtəlif kristal quruluşlara səbəb olur. Beləliklə, Na + ionlarının (onların radiusu 0,1 nm-dir) və Cl – (onların radiusu 0,18 nm) qarşılıqlı təsiri zamanı oktaedral koordinasiya baş verir: hər bir ion oktaedrin təpələrində yerləşən əks işarəli altı ionu özünə yaxın saxlayır. . Bu zaman bütün kationlar və anionlar kubun təpələrini növbə ilə Na+ və Cl – ionları tutduğu ən sadə kub kristal qəfəsini əmələ gətirir. KCl, BaO, CaO və bir sıra digər maddələrin kristalları oxşar quruluşa malikdir.
Cs + ionları (radius 0,165 nm) ölçülərinə görə Cl – ionlarına yaxındır və kubik koordinasiya baş verir: hər bir ion kubun təpələrində yerləşən əks işarəli səkkiz ionla əhatə olunmuşdur. Bu zaman bədən mərkəzli kristal qəfəs əmələ gəlir: səkkiz kationdan əmələ gələn hər kubun mərkəzində bir anion yerləşir və əksinə. (Maraqlıdır ki, 445°C-də CsCl NaCl kimi sadə kub qəfəsə çevrilir.) CaF 2 (flüorit) və bir çox başqa ion birləşmələrinin kristal qəfəsləri daha mürəkkəbdir. Bəzi ion kristallarında mürəkkəb poliatomik anionlar zəncirlərdə, təbəqələrdə birləşdirilə və ya boşluqlarında kationların yerləşdiyi üçölçülü çərçivə yarada bilər. Məsələn, silikatların quruluşu belədir. İon kristalları qeyri-üzvi və üzvi turşuların, oksidlərin, hidroksidlərin və duzların əksər duzlarını əmələ gətirir. İon kristallarında ionlar arasındakı bağlar güclüdür, buna görə də belə kristalların yüksək ərimə nöqtələri var (NaCl üçün 801 ° C, CaO üçün 2627 ° C).
Kovalent kristallarda (onlara atom kristalları da deyilir) kristal qəfəsin düyünlərində kovalent bağlarla bağlanan eyni və ya fərqli atomlar var. Bu əlaqələr güclüdür və müəyyən bucaqlara yönəldilmişdir. Tipik bir nümunə almazdır; onun kristalında hər bir karbon atomu tetraedrin təpələrində yerləşən dörd başqa atoma bağlıdır. Kovalent kristallar bor, silisium, germanium, arsen, ZnS, SiO 2, ReO 3, TiO 2, CuNCS əmələ gətirir. Qütb kovalent və ion rabitələri arasında kəskin sərhəd olmadığı üçün eyni şey ion və kovalent kristallar üçün də keçərlidir. Beləliklə, Al 2 O 3-də alüminium atomunun yükü +3 deyil, yalnız +0,4-dür ki, bu da kovalent quruluşun böyük bir töhfəsini göstərir. Eyni zamanda, kobalt alüminatında CoAl 2 O 4 alüminium atomlarının yükü +2,8-ə qədər artır, bu da ion qüvvələrin üstünlük təşkil etməsi deməkdir. Kovalent kristallar ümumiyyətlə sərt və odadavamlıdır.
Molekulyar kristallar, nisbətən zəif cazibə qüvvələrinin hərəkət etdiyi təcrid olunmuş molekullardan qurulur. Nəticədə, belə kristalların ərimə və qaynama nöqtələri çox aşağı olur və onların sərtliyi aşağıdır. Beləliklə, nəcib qazların kristalları (onlar təcrid olunmuş atomlardan qurulur) çox aşağı temperaturda əriyir. Qeyri-üzvi birləşmələrdən molekulyar kristallar çoxlu qeyri-metallar (nəcib qazlar, hidrogen, azot, ağ fosfor, oksigen, kükürd, halogenlər), molekulları yalnız kovalent bağlarla (H 2 O, HCl, NH 3, CO 2) əmələ gələn birləşmələr əmələ gətirir. və s.). Bu tip kristal həm də demək olar ki, bütün üzvi birləşmələr üçün xarakterikdir. Molekulyar kristalların gücü molekulların ölçüsündən və mürəkkəbliyindən asılıdır. Beləliklə, helium kristalları (atom radiusu 0,12 nm) –271,4°C-də (30 atm təzyiq altında), ksenon kristalları (radius 0,22 nm) isə –111,8°C-də əriyir; flüor kristalları -219,6 ° C-də, yod isə +113,6 ° C-də əriyir; metan CH 4 – –182,5° C-də, triakontan C 30 H 62 – +65,8° C-də.
Metal kristalları təmiz metalları və onların ərintilərini əmələ gətirir. Belə kristalları qırıq metallarda, eləcə də sinklənmiş təbəqənin səthində görmək olar. Metalların kristal qəfəsləri mobil elektronlarla (“elektron qazı”) bağlanan kationlardan əmələ gəlir. Bu struktur kristalların elektrik keçiriciliyini, elastikliyini və yüksək əks etdirmə qabiliyyətini (parlaqlığını) müəyyən edir. Metal kristalların quruluşu kürə atomlarının müxtəlif qablaşdırılması nəticəsində əmələ gəlir. Qələvi metallar, xrom, molibden, volfram və s. bədən mərkəzli kub qəfəs əmələ gətirir; mis, gümüş, qızıl, alüminium, nikel və s. - üz mərkəzli kub qəfəs (kubun təpələrində 8 atomdan əlavə, üzlərin mərkəzində daha 6 atom yerləşir); berilyum, maqnezium, kalsium, sink və s. - sözdə altıbucaqlı sıx qəfəs (onda 12 atom düzbucaqlı altıbucaqlı prizmanın təpələrində, 2 atom prizmanın iki əsasının mərkəzində və daha 3 atom yerləşir. prizmanın mərkəzindəki üçbucağın təpələrində).
Bütün kristal birləşmələri mono və polikristallara bölmək olar. Tək kristal tək pozulmamış kristal qəfəsi olan monolitdir. Böyük ölçülü təbii monokristallar çox nadirdir. Kristal bərk cisimlərin çoxu polikristaldir, yəni onlar çoxlu kiçik kristallardan ibarətdir, bəzən yalnız yüksək böyüdülmə zamanı görünə bilər.
Kristal böyüməsi.
Kimya, mineralogiya və digər elmlərin inkişafına böyük töhfə vermiş bir çox görkəmli alimlər kristalların böyüməsi ilə bağlı ilk təcrübələrinə başlamışlar. Bu təcrübələr sırf xarici təsirlərlə yanaşı, kristalların necə qurulduğu və necə əmələ gəldiyi, niyə müxtəlif maddələrin müxtəlif formalı kristallar verdiyi, bəzilərinin isə ümumiyyətlə kristal əmələ gətirmədiyi, kristalların əmələ gəlməsi üçün nə etmək lazım olduğu barədə düşünməyə vadar edir. böyük və gözəl.
Burada kristallaşmanın mahiyyətini izah edən sadə bir model var. Təsəvvür edək ki, böyük bir zalda parket döşənir. Kvadrat formalı plitələr ilə işləmək ən asandır - belə bir kafel necə çevirsəniz də, yenə də öz yerinə uyğunlaşacaq və iş tez gedəcəkdir. Bu səbəbdən atomlardan (metallar, nəcib qazlar) və ya kiçik simmetrik molekullardan ibarət birləşmələr asanlıqla kristallaşır. Belə birləşmələr, bir qayda olaraq, kristal olmayan (amorf) maddələr əmələ gətirmir.
Düzbucaqlı taxtalardan parket qoymaq daha çətindir, xüsusən də yanlarında yivlər və çıxıntılar varsa - onda hər taxta bir şəkildə öz yerinə qoyula bilər. Mürəkkəb formalı taxtalardan parket naxışını çəkmək xüsusilə çətindir.
Parket döşəməsi tələsirsə, plitələr quraşdırma yerinə çox tez çatacaq. Aydındır ki, indi düzgün naxış işləməyəcək: kafel ən azı bir yerdə əyilibsə, hər şey əyri olacaq və boşluqlar görünəcək ("şüşə" hissələrlə doldurulduğu köhnə Tetris kompüter oyununda olduğu kimi). çox tez). Böyük zalda birdən-birə onlarla usta parket çəkməyə başlasa, bundan yaxşı heç nə çıxmayacaq - hərəsi öz yerindən. Yavaş-yavaş işləsələr də, bitişik bölmələrin yaxşı bağlanacağı son dərəcə şübhəlidir və ümumiyyətlə, otağın görünüşü çox yararsız olacaq: müxtəlif yerlərdə plitələr müxtəlif istiqamətlərdə yerləşir və arasında boşluqlar var. hətta parketin fərdi bölmələri.
Təxminən eyni proseslər kristalların böyüməsi zamanı baş verir, yalnız burada çətinlik odur ki, hissəciklər bir müstəvidə deyil, həcmdə yerləşməlidir. Ancaq burada "parket döşəmə" yoxdur - maddənin hissəciklərini öz yerinə kim qoyur? Belə çıxır ki, onlar davamlı olaraq istilik hərəkətləri etdikləri üçün özlərini yerə qoyurlar və özləri üçün ən uyğun, ən "rahat" olacaqları yer "axtarırlar". Bu vəziyyətdə "rahatlıq" həm də enerji baxımından ən əlverişli yeri nəzərdə tutur. Böyüyən bir kristalın səthində belə bir yerdə bir dəfə maddənin bir hissəciyi orada qala bilər və bir müddət sonra kristalın içərisinə, yeni artan maddə təbəqələrinin altına düşə bilər. Ancaq başqa bir şey də mümkündür - hissəcik yenidən səthi məhlulun içərisinə buraxacaq və yenidən yerləşməsi üçün daha əlverişli olan yeri "axtarmağa" başlayacaq.
Hər bir kristal maddə ona xas olan müəyyən bir xarici kristal formasına malikdir. Məsələn, natrium xlorid üçün bu forma kub, kalium alum üçün oktaedrdir. Əvvəlcə belə bir kristalın qeyri-müntəzəm forması olsa belə, gec-tez bir kub və ya oktaedra çevriləcəkdir. Üstəlik, düzgün formaya malik bir kristal qəsdən zədələnirsə, məsələn, təpələri sökülürsə, kənarları və üzləri zədələnirsə, daha da böyüməsi ilə belə bir kristal öz zədəsini "müalicə etməyə" başlayacaq. Bu, kristalın "düzgün" kənarlarının daha sürətli böyüməsi və "yanlış" olanların daha yavaş böyüməsi səbəbindən baş verir. Bunu yoxlamaq üçün aşağıdakı təcrübə aparıldı: süfrə duzunun kristalından top oyulmuş və sonra doymuş NaCl məhluluna qoyulmuşdur; Bir müddət sonra topun özü tədricən kuba çevrildi! düyü. 6 Bəzi mineralların kristal formaları
Kristallaşma prosesi çox sürətlə getmirsə və hissəciklər yerləşmə üçün əlverişli formaya və yüksək hərəkət qabiliyyətinə malikdirlərsə, onlar öz yerlərini asanlıqla tapırlar. Aşağı simmetriyaya malik hissəciklərin hərəkətliliyi kəskin şəkildə azalarsa, onlar təsadüfi olaraq şüşəyə bənzər şəffaf bir kütlə meydana gətirərək "donurlar". Maddənin bu halı şüşəsi adlanır. Bir nümunə adi pəncərə şüşəsidir. Şüşə uzun müddət çox isti saxlanılırsa, içindəki hissəciklər kifayət qədər hərəkətli olduqda, silikat kristalları onda böyüməyə başlayacaq. Belə şüşə öz şəffaflığını itirir. Yalnız silikatlar şüşəli ola bilməz. Beləliklə, etil spirti yavaş-yavaş soyuduqda –113,3°C temperaturda kristallaşaraq ağ qar kimi kütlə əmələ gətirir. Ancaq soyutma çox tez aparılarsa (nazik bir ampula spirtini -196 ° C temperaturda maye azota batırın), spirt o qədər tez qatılaşacaq ki, molekullarının düzgün kristal yaratmağa vaxtı olmayacaq. Nəticə şəffaf şüşədir. Eyni şey silikat şüşə ilə baş verir (məsələn, pəncərə şüşəsi). Çox sürətli soyutma ilə (saniyədə milyonlarla dərəcə), hətta metallar kristal olmayan şüşəli vəziyyətdə əldə edilə bilər.
“Əlverişsiz” molekulyar formalı maddələrin kristallaşması çətindir. Belə maddələrə, məsələn, zülallar və digər biopolimerlər daxildir. Amma ərimə temperaturu +18° C olan adi qliserin soyuduqda asanlıqla supersoyuyur, tədricən şüşə kimi bərkiyir. Fakt budur ki, artıq otaq temperaturunda qliserin çox viskozdur və soyuduqda tamamilə qalınlaşır. Eyni zamanda, asimmetrik qliserin molekullarının ciddi bir ardıcıllıqla düzülməsi və kristal qəfəs əmələ gəlməsi çox çətindir.
Kristalların yetişdirilməsi üsulları.
Kristallaşma müxtəlif yollarla həyata keçirilə bilər. Onlardan biri doymuş isti məhlulun soyudulmasıdır. Hər temperaturda müəyyən miqdarda maddə müəyyən miqdarda həlledicidə (məsələn, suda) həll edilə bilməz. Məsələn, 200 q kalium alum 90 ° C-də 100 q suda həll edilə bilər. Bu məhlul doymuş adlanır. İndi həlli soyudacağıq. Temperatur azaldıqca əksər maddələrin həllolma qabiliyyəti azalır. Beləliklə, 80 ° C-də 100 q suda 130 q-dan çox olmayan alum həll edilə bilməz. Qalan 70 q hara gedəcək? Soyutma tez həyata keçirilərsə, artıq maddə sadəcə çökəcək. Bu çöküntü qurudulub güclü böyüdücü şüşə ilə araşdırılarsa, çoxlu kiçik kristallar görə bilərsiniz.
Məhlul soyuduqda, artıq həll olunmuş vəziyyətdə ola bilməyən maddənin hissəcikləri (molekullar, ionlar) bir-birinə yapışaraq kiçik kristal nüvələr əmələ gətirir. Nüvələrin əmələ gəlməsi məhluldakı çirklər, məsələn, toz, damarın divarlarındakı kiçik pozuntular (kimyaçılar bəzən maddənin kristallaşmasına kömək etmək üçün şüşənin daxili divarlarına bir şüşə çubuq sürtürlər) ilə asanlaşdırılır. Məhlul yavaş-yavaş soyudulursa, bir neçə nüvə əmələ gəlir və tədricən hər tərəfdən böyüyərək müntəzəm formalı gözəl kristallara çevrilir. Sürətli soyutma ilə çoxlu nüvələr əmələ gəlir və məhluldan olan hissəciklər cırılmış torbadan noxud kimi böyüyən kristalların səthinə "düşəcək"; Əlbəttə ki, bu, düzgün kristalları əmələ gətirməyəcək, çünki məhluldakı hissəciklərin kristalın səthində öz yerində "yerləşməyə" sadəcə vaxtı olmaya bilər. Bundan əlavə, bir otaqda işləyən bir neçə parket işçisi kimi, bir çox sürətlə böyüyən kristallar bir-birinə müdaxilə edir. Məhluldakı xarici bərk çirklər də kristallaşma mərkəzləri kimi çıxış edə bilər, buna görə də məhlul nə qədər təmiz olarsa, kristallaşma mərkəzlərinin az olma şansı bir o qədər çox olar.
90°C-də doymuş alum məhlulunu otaq temperaturuna qədər soyudaraq biz çöküntüdə 190 q alum əldə edirik, çünki 20°C-də 100 q suda yalnız 10 q alum həll olur. Bu, 190 q ağırlığında normal formada bir böyük kristalla nəticələnəcəkmi? Təəssüf ki, yox: hətta çox təmiz məhlulda belə tək kristalın böyüməyə başlaması ehtimalı azdır: soyuducu məhlulun səthində kristal kütləsi əmələ gələ bilər, burada temperatur kütlədən bir qədər aşağıdır, həmçinin gəminin divarlarında və dibində olduğu kimi.
Doymuş məhlulun tədricən soyudulması yolu ilə kristalların yetişdirilməsi üsulu, həllolma qabiliyyəti temperaturdan az asılı olan maddələrə şamil edilmir. Belə maddələrə, məsələn, natrium və alüminium xloridləri, kalsium asetat daxildir.
Kristalların alınması üçün başqa bir üsul suyun doymuş məhluldan tədricən çıxarılmasıdır. “Artıq” maddə kristallaşır. Və bu halda su nə qədər yavaş buxarlanırsa, bir o qədər yaxşı kristallar alınır.
Üçüncü üsul mayenin yavaş-yavaş soyudulması yolu ilə ərimiş maddələrdən kristalların yetişdirilməsidir. Bütün üsulları istifadə edərkən, bir toxum istifadə edilərsə, ən yaxşı nəticələr əldə edilir - bir həll və ya əriməyə yerləşdirilən düzgün formalı kiçik bir kristal. Bu yolla, məsələn, yaqut kristalları əldə edilir. Qiymətli daş kristallarının yetişdirilməsi çox yavaş, bəzən illər ərzində aparılır. Kristallaşmanı sürətləndirsəniz, bir kristalın əvəzinə kiçik bir kütlə alacaqsınız.
Kristallar buxar qatılaşdıqda da böyüyə bilər, soyuq şüşə üzərində qar dənəcikləri və naxışlar yaradır. Metallar daha aktiv metalların köməyi ilə duzlarının məhlullarından çıxarıldıqda kristallar da əmələ gəlir. Məsələn, dəmir mismar mis sulfat məhluluna batırılırsa, qırmızı mis təbəqəsi ilə örtüləcəkdir. Lakin yaranan mis kristalları o qədər kiçikdir ki, onları yalnız mikroskop altında görmək mümkündür. Mis dırnaq səthinə çox tez buraxılır, buna görə də onun kristalları çox kiçikdir. Amma proses ləngisə, kristallar böyük olacaq. Bunu etmək üçün mis sulfatı qalın bir təbəqə duzu ilə örtün, üzərinə bir dairə filtr kağızı qoyun və üstə - bir az daha kiçik diametrli bir dəmir plaka qoyun. Qalan şey, qaba yemək duzunun doymuş bir həllini tökməkdir. Mis sulfat duzlu suda yavaş-yavaş həll olunmağa başlayacaq (onun içindəki həllolma təmiz sudan daha azdır). Mis ionları (mürəkkəb yaşıl CuCl 4 2- anionları şəklində) bir neçə gün ərzində çox yavaş yuxarıya doğru yayılacaq; prosesi rəngli haşiyənin hərəkəti ilə müşahidə etmək olar.
Dəmir lövhəyə çatdıqdan sonra mis ionları neytral atomlara qədər azalır. Lakin bu proses çox yavaş baş verdiyindən, mis atomları metal misin gözəl parlaq kristallarına düzülür. Bəzən bu kristallar budaqlar - dendritlər əmələ gətirir. Təcrübə şərtlərini (temperatur, vitriol kristallarının ölçüsü, duz təbəqəsinin qalınlığı və s.) dəyişdirərək misin kristallaşması şərtlərini dəyişə bilərsiniz.
Aşırı soyudulmuş həllər.
Bəzən doymuş məhlul soyuduqda kristallaşmır. Müəyyən miqdarda həlledicidə müəyyən bir temperaturda "gözləniləndən" daha çox həlledici olan belə bir məhlul həddindən artıq doymuş məhlul adlanır. Həddindən artıq doymuş məhlul hətta kristalların bir həlledici ilə çox uzun müddət qarışdırılması ilə əldə edilə bilməz; Buna görə də belə məhlullara supercooled də deyilir. Onlarda kristallaşmanın başlamasına bir şey mane olur, məsələn, məhlul çox viskozdur və ya kristal böyüməsi üçün məhlulda olmayan böyük nüvələr tələb olunur.
Natrium tiosulfat Na 2 S 2 O 3 məhlulları asanlıqla həddindən artıq soyudulur. 5H 2 O. Bu maddənin kristallarını diqqətlə təxminən 56 ° C-yə qədər qızdırsanız, onlar "əriyir". Əslində, bu ərimə deyil, natrium tiosulfatın "öz" kristallaşma suyunda əriməsidir. Artan temperaturla, əksər digər maddələr kimi, natrium tiosulfatın həllolma qabiliyyəti artır və 56 ° C-də onun kristallaşma suyu bütün mövcud duzları həll etmək üçün kifayətdir. İndi qəfil zərbələrdən qaçaraq, gəmini diqqətlə soyudunsa, kristallar əmələ gəlməyəcək və maddə maye qalacaq. Ancaq hazır embrion - eyni maddənin kiçik bir kristalı - həddindən artıq soyudulmuş bir məhlula daxil edilərsə, sürətli kristallaşma başlayacaq. Maraqlıdır ki, buna yalnız bu maddənin kristalı səbəb olur və məhlul yad maddəyə tamamilə laqeyd qala bilər. Buna görə də, məhlulun səthinə kiçik bir tiosulfat kristalına toxunsanız, əsl möcüzə baş verəcək: kristaldan kristallaşma cəbhəsi axacaq və bu, tez bir zamanda gəminin dibinə çatacaq. Beləliklə, bir neçə saniyədən sonra maye tamamilə "bərkləşəcək". Siz hətta gəmini çevirə bilərsiniz - ondan bir damla belə tökülməyəcək! Bərk tiosulfat yenidən qaynar suda əridilə və yenidən təkrarlana bilər.
Tərkibində həddindən artıq soyudulmuş tiosulfat məhlulu olan sınaq borusu buzlu suya qoyularsa, kristallar daha yavaş böyüyəcək və daha böyük olacaqdır. Həddindən artıq doymuş məhlulun kristallaşması onun qızdırılması ilə müşayiət olunur - bu, əriməsi zamanı kristal hidrat tərəfindən əldə edilən istilik enerjisini buraxır.
Natrium tiosulfat, sürətli kristallaşmaya səbəb ola biləcək həddindən artıq soyudulmuş bir məhlul meydana gətirən yeganə maddə deyil. Məsələn, natrium asetat CH 3 COONa oxşar xüsusiyyətə malikdir (onu sirkə turşusunun sodaya təsiri ilə asanlıqla əldə etmək olar). Natrium asetat ilə təcrübəli müəllimlər bu "möcüzəni" nümayiş etdirirlər: bir boşqabdakı kiçik bir asetat yığınına yavaş-yavaş bu duzun həddindən artıq doymuş məhlulunu tökürlər, kristallarla təmasda olduqda dərhal kristallaşır və bərk duz sütunu əmələ gətirir!
Kristallardan elm və texnikada geniş istifadə olunur: yarımkeçiricilər, optik cihazlar üçün prizmalar və linzalar, bərk cisimli lazerlər, pyezoelektriklər, ferroelektriklər, optik və elektro-optik kristallar, ferromaqnitlər və ferritlər, yüksək təmizlikli metalların monokristalları...
Kristalların rentgen struktur tədqiqatları bir çox molekulların, o cümlədən bioloji aktiv olanların - zülalların, nuklein turşularının quruluşunu yaratmağa imkan verdi.
Qiymətli daşların üzlü kristalları, o cümlədən süni şəkildə yetişdirilənlər zərgərlik kimi istifadə olunur.
İlya Leenson
CƏsur MANQARLAR
Tikinti sxemi
CƏsur qəfəslər, kristalların translyasiya simmetriyasının bütün mümkün növlərini xarakterizə edən 14 üçölçülü həndəsi qəfəslər. Bravais qəfəsləri kristalın istənilən nöqtəsinə köçürmə əməliyyatının (tərcümə) hərəkəti ilə əmələ gəlir.
O. Bravais 1848-ci ildə göstərdi ki, kristal strukturların bütün müxtəlifliyi vahid hüceyrələrin forması və simmetriyası ilə fərqlənən və 7 kristalloqrafik sistemə bölünən 14 növ qəfəsdən istifadə etməklə təsvir edilə bilər. Bu qəfəslər Bravais qəfəsləri adlanırdı.
Bravais qəfəsləri vahid hüceyrənin simmetriyasında, yəni onun kənarları və küncləri arasındakı əlaqə, eləcə də mərkəzləşdirmə ilə fərqlənir.
Bravais xanasını seçmək üçün üç şərtdən istifadə olunur:
Vahid hüceyrənin simmetriyası kristalın simmetriyasına, daha dəqiq desək, kristalın aid olduğu sistemin ən yüksək simmetriyasına uyğun olmalıdır. Vahid hüceyrənin kənarları qəfəs tərcümələri olmalıdır;
Vahid hücrədə mümkün olan maksimum sayda düz bucaq və ya bərabər bucaqlar və bərabər kənarlar olmalıdır;
Vahid hüceyrənin minimum həcmi olmalıdır.
Əsas tərcümələrin nisbi yerləşməsinin təbiətinə və ya qovşaqların yerləşməsinə görə bütün kristal qəfəslər dörd növə bölünür: primitiv ( R), əsas mərkəzli ( İLƏ), bədən mərkəzli ( I), üz mərkəzli ( F).
Primitiv olaraq R-hüceyrə, qəfəs düyünləri yalnız hüceyrənin təpələrində, bədən mərkəzli bir yerdə yerləşir. I-hüceyrə - hüceyrənin mərkəzində, üz mərkəzli bir düyün F-hüceyrə - hər üzün mərkəzində bir düyün, əsas mərkəzli İLƏ-hüceyrə - bir cüt paralel üzün mərkəzlərində bir node.
Elementar xanaya daxil olan qovşaqların koordinatları toplusu xananın əsası adlanır. Bütün kristal quruluşu Bravais hüceyrəsinin bir sıra tərcümələri ilə əsas düyünləri təkrarlamaqla əldə edilə bilər.
Bəzi sinqoniyalar üçün vahid hüceyrə yalnız künclərdə deyil, həm də hüceyrənin mərkəzində, bütün və ya bəzi üzlərdə düyünləri ehtiva edə bilər. Bu halda translyasiya ötürülməsi yalnız vahid hüceyrənin dövrlərinə deyil, həm də hüceyrə üzlərinin diaqonallarının yarısına və ya məkan diaqonallarına da mümkündür. Məcburi tərcümə dəyişməzliyinə əlavə olaraq, qəfəs fırlanma, əks və inversiya daxil olmaqla digər transformasiyalar zamanı özünə çevrilə bilər. Məhz bu əlavə simmetriyalar Bravais qəfəsinin növünü müəyyən edir və onu digərlərindən fərqləndirir.
Bravais barmaqlıqlarının növləri:
Kub: primitiv, bədən mərkəzli və üz mərkəzli;
altıbucaqlı, üçbucaqlı;
Tetraqonal: primitiv və həcm mərkəzləşdirilmiş;
Rombik: primitiv, əsas, bədən və üz mərkəzli;
Monoklinik: ibtidai və əsas mərkəzli;
Triklinik.

Sinqoniya(yunan σύν, "birlikdə, yanında" və γωνία, "bucaq" - sözün əsl mənasında "oxşar bucaq") - koordinat sistemindən asılı olaraq kristalloqrafik simmetriya qruplarının, kristalların və kristal qəfəslərin təsnifatı (koordinat istinadı). Tək koordinat sistemi olan simmetriya qrupları bir sistemdə birləşdirilir.
Eyni sistemə aid olan kristallar vahid hüceyrələrin oxşar açılarına və kənarlarına malikdir.
· Triklinik: (\displaystyle a\neq b\neq c), (\displaystyle \alpha \neq \beta \neq \qamma \neq 90^(\circ ))
· Monoklinik: (\displaystyle a\neq b\neq c), (\displaystyle \alpha =\qamma =90^(\circ ),\beta \neq 90^(\circ ))
· Rombik: (\displaystyle a\neq b\neq c), (\displaystyle \alpha =\beta =\qamma =90^(\circ ))
· Tetraqonal: (\displaystyle a=b\neq c), (\displaystyle \alpha =\beta =\qamma =90^(\circ ))
· Altıbucaqlı: (\displaystyle a=b\neq c), (\displaystyle \alpha =\beta =90^(\circ ),\qamma =120^(\circ ))
· Kub: (\displaystyle a=b=c), (\displaystyle \alpha =\beta =\qamma =90^(\circ ))

Kristal strukturların əsas xüsusiyyətləri
Kristal materiallar xarakterik olan uzunmüddətli nizamın olması ilə xarakterizə olunur. onda müəyyən bir həcmi ayırd etmək olar ki, atomun düzülüşü bütün həcm boyu təkrarlanır.
Amorf həsirlərdə qısa məsafəli nizam var, pişik. xarakter mövzular ki, cildlərin təkrarı yoxdur.
Krist. Z istifadə edərək strukturu təsvir etmək rahatdır X məkanı bərabər ölçülü paralelepipidlərə bölən düz xətlərin ölçülü şəbəkəsi. Xətlərin kəsişməsi 3 ölçülü boşluqların təsviridir. sürtmək. Şəbəkə yerləri, bir qayda olaraq, kristaldakı atomların düzülüşünə uyğundur. Atom titrəyir
bu mövqelər ətrafında. Əgər belə bir məkan şəbəkəsində onu 3 istiqamətdə hərəkət etdirərək müəyyən bir həcmi seçmək mümkündür. bütün kristalı sıralamağa imkan verir, sonra gov. Bir element və ya hüceyrə tapıldı.
Hüceyrə elementi adətən 6 parametrlə xarakterizə olunur: a, b, c - paralelepipedin kənarlarının uzunluğu, α, β, γ.
Hüceyrə elementinin forması kristalloqrafik koordinat sistemini - sinqoniyanı müəyyən edir. Kənarların istiqamətləri baltalar kimi seçilir - elementlər, hüceyrələr və kənarların özləri ölçü vahidləridir. Düz bucaqların və bərabər tərəflərin sayı maksimum, hüceyrə elementinin həcmi isə min olmalıdır.